开发新型适配体 为治疗癌症和神经系统疾病带来转机
G-四链体结构(G-quadruplexes,简称G4)是去氧核糖核酸(DNA)和核糖核酸(RNA)中的特殊结构,对细胞具有重要作用,并与癌症和神经系统疾病有所关联。香港城市大学(城大)的研究团队最近建立了一个全新的平台,能够选择靶向G4结构的L-RNA适配体(aptamers)。该平台成功筛选出一种L-RNA适配体,能结合至特定的G4拓扑结构(平行G4)。这一研究发现有助于开发治疗与G4相关疾病(如癌症)的新药物和治疗方法。
该研究成果已发表在知名期刊《核酸研究》(Nucleic Acids Research)上,题为<Selective targeting of parallel G-quadruplex structure using L-RNA aptamer>。
在传统方法上,如有机小分子、抗体和多肽已被用于靶向G4,然而只有少数能与特定的G4构象形成相互作用。此外,这些方法在基因调控方面的应用,特别是在内源基因水平上的应用,尚未得到广泛研究,存在着重大的研究和知识差距。为克服这个问题,建立能够特异性靶向特定的G4构象的通用平台和新型工具有重大意义。
城大化学系郭骏杰教授解释道:“作为D-RNA的非天然对映体形式,L-RNA适配体是一种有前景的新型核酸靶向工具,尽管它们的开发仍处于早期阶段,迄今为止只有少数的功能性核酸靶标进行了研究。”
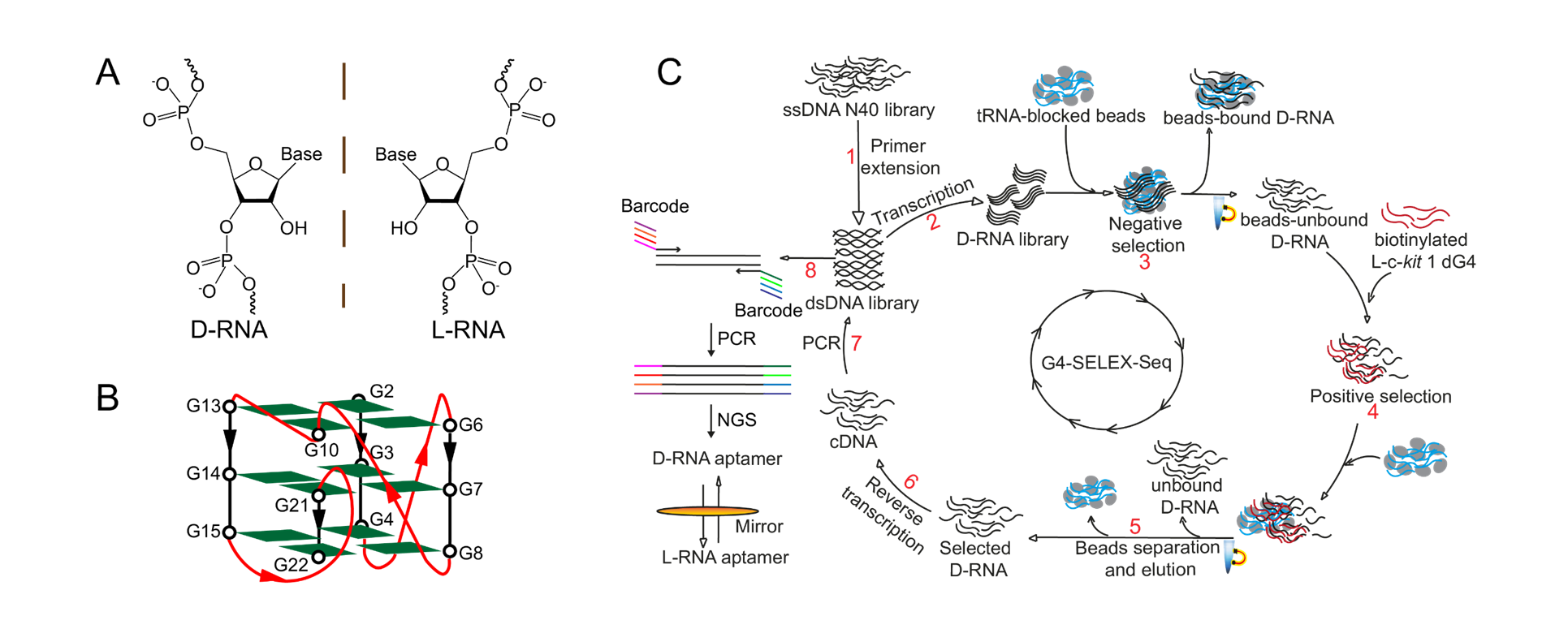
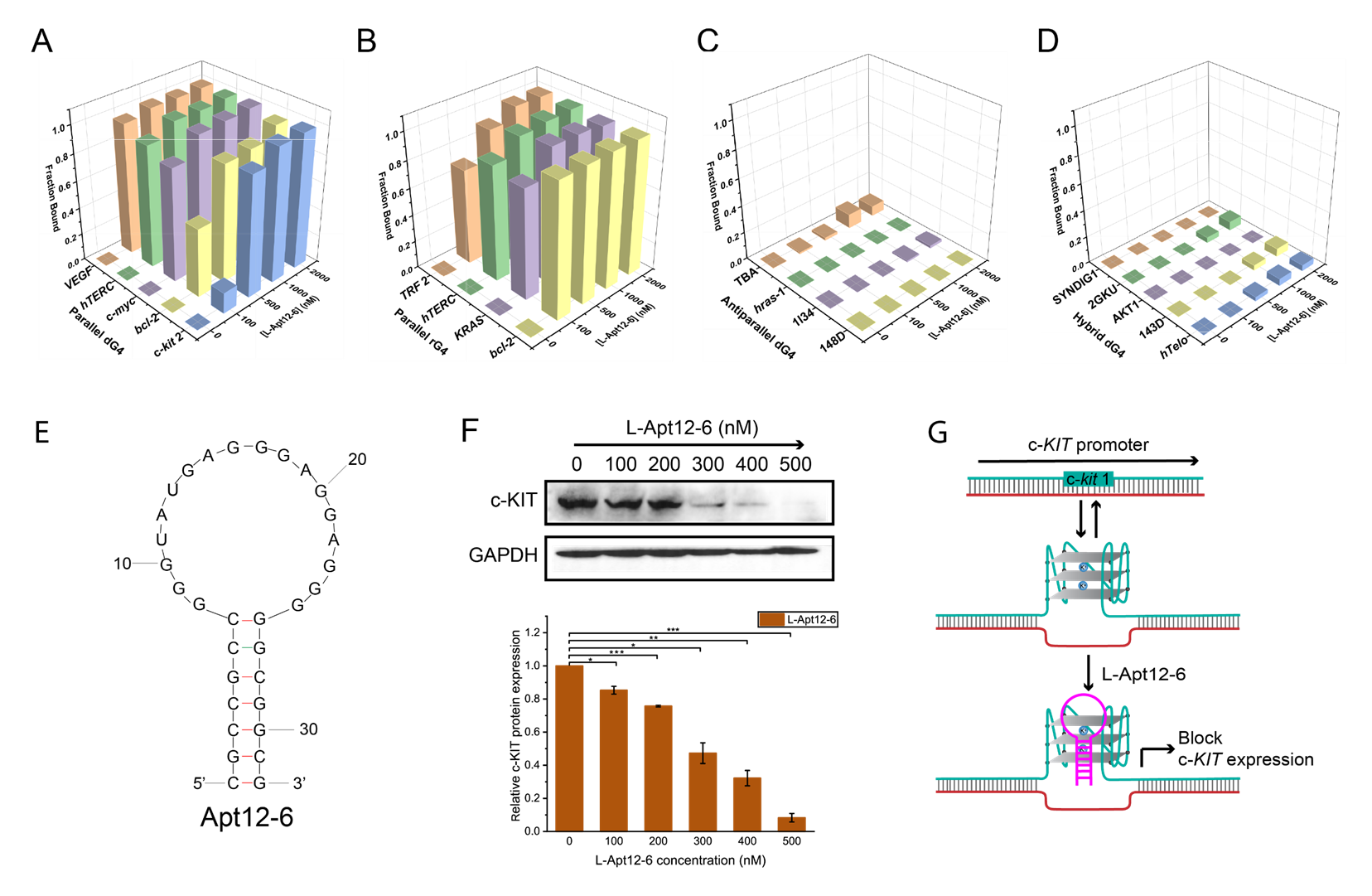
他说:“在这项研究中,我们首次引入了一种新型的高通量的L-RNA适配体筛选方法,称为G4-SELEX-Seq。通过使用这个新型筛选方法,我们鉴定出一种新L-RNA适配体,名为L-Apt12-6。它能特异性识别平行G4结构。这也是首个能够特异性靶向平行G4构象的L-RNA适配体。更重要的是,我们还证明了L-Apt12-6可以控制癌细胞中原癌基因c-kit1的基因表达。”
研究论文的第一作者及目前在郭教授实验室中的担任博士后研究员的姬丹阳博士补充说:“我们花费逾一年时间对适配体选择平台进行反复的故障排除和改进。SELEX过程中的非特异性富集阻碍了有效结合序列的筛选。”为了克服这个问题,他们采用了高通量的二代测序(NGS)全面分析富集的文库。郭教授及姬博士兴奋地指出:“这个过程就如大海捞针!”。经过多次尝试后,成功确定了一个适用于下游应用的候选适配体序列。
“新开发的SELEX策略(即G4-SELEX-Seq),可以通过适当的改进用于其他核酸结构。”郭教授强调新策略的普遍应用潜力。
新筛选出来的L-Apt12-6在选择性地识别G-四链体构象方面具有重要价值。它表现出在体外和细胞内调控G4介导的基因活性的能力。通过连接各种功能模组的蛋白、多肽、核酸或配体,L-Apt12-6可以进一步定制,使其在广泛的环境中,包括生物医学和生物技术领域,得以应用。

如有查询,欢迎联络城大化学系郭骏杰教授(电邮: ckkwok42@cityu.edu.hk)。